CART细胞疗法治疗癌症的最新综述2021-06-30 14:04:42
免疫疗法
免疫疗法可以被认为是治疗癌症、自身免疫性疾病以及过敏和超敏性疾病等各种疾病的一种有前途的方法。CD8+ T 淋巴细胞在肿瘤根除中发挥关键作用。T细胞治疗的主要途径描述如下:肿瘤浸润淋巴细胞(TIL)治疗、工程化TCR和嵌合抗原受体(CAR)。
1989 年,第一个嵌合 TCR 是通过将单链可变片段 (scFv) 直接连接到 α 或 βTCR 链之一的 C 区而创建的。CAR 是在 T 和 NK 细胞表面表达的蛋白质,包含细胞外结合域、介导细胞外与跨膜域连接的铰链区、跨膜域和细胞内信号域。CAR 的使用具有多种优势,例如:CAR 蛋白以独立于主要组织相容性复合体 (MHC) 的方式识别 TAA,因此,该特征使 T 细胞能够通过下调 MHC 来克服肿瘤逃避免疫识别的能力细胞表面的分子。无论 MHC 类型如何,CAR 的使用都适用于广泛的患者,因为肿瘤靶向不限于 MHC 分子。CAR蛋白能够识别任何细胞表面抗原,包括蛋白质、碳水化合物和糖脂。与天然 TCR 相比,这些受体使基因修饰的 T 细胞能够对更广泛的分子作出反应。用于表达 CAR 蛋白的T 细胞工程可以重新定向大多数 T 细胞群的特异性,包括CD4、CD8、幼稚和记忆或 T 细胞效应器。这一点非常重要,因为初始 T 细胞和抗原经历过的 T 细胞具有不同的功能,这可以使它们或多或少地对过继细胞治疗有效。CAR 修饰可能涉及一种或多种 T 细胞激活信号,这些信号与 T 细胞增殖、持续和裂解靶细胞的更高潜力相关。最后,在适度短的时间内产生大量肿瘤特异性 T 细胞的能力使该技术在临床背景中更具吸引力。
CAR 修饰的 T 细胞生产
为了产生 CAR 修饰的 T 细胞,CD4+ 和 CD8+ T 淋巴细胞通过白细胞分离术从患者的血液中分离出来。然后用病毒载体(如慢病毒)转染分离的 T 细胞,该载体含有针对肿瘤靶抗原的 CAR 基因。病毒与T细胞膜结合并与细胞膜融合,然后发生逆转录、DNA整合、CAR基因表达以及CAR蛋白插入T细胞细胞膜的过程。然后,转基因 T 细胞在实验室中与足量的 IL-2 一起培养。为了降低白细胞水平,患者接受了淋巴耗竭调理化疗。随后,注射自体 CAR T 细胞,患者监测治疗反应和修饰的 T 细胞的功能。CAR特异性
通过 CAR 进行抗原靶向是 CAR 设计的关键点。通常,CAR 对目标的识别包括使用由单克隆抗体组装而成的 scFv。T 细胞的 CAR 修饰只能识别靶细胞表面表达的抗原。此外,scFv 靶向肿瘤类似于抗原-抗体相互作用。各种因素,包括结合域的亲和力、表位的结构和在肿瘤细胞上表达的抗原量,都会影响修饰的 T 细胞对靶抗原的反应。几项研究已经解决了细胞外结构域的各种锚定配体,这些配体包含针对肿瘤细胞表面某些分子的 scFv,或在 CAR的 N 端设计的一些试剂(如亲和素) ,识别与单克隆抗体偶联的可溶性生物素靶标。
到目前为止,基因工程 T 细胞已成功开发出针对各种肿瘤抗原,如 CD19 和 CD20,用于治疗 B 细胞恶性肿瘤、ERRB2用于治疗前列腺癌和乳腺癌,碳酸酐酶 IX(CAIX)用于治疗肾细胞癌,前列腺特异性膜抗原 (PSMA) 用于治疗前列腺癌,Lewis Y 用于治疗,癌胚抗原用于治疗肺癌治疗结肠癌 , TAG72 用于治疗乳腺癌、结肠直肠癌、胰腺癌等, 叶酸结合蛋白和 MUC16 用于治疗卵巢癌,以及用于t 的双唾液酸神经节苷脂 GD2神经母细胞瘤的治疗。研究表明,各种含有受体多肽配体的 CAR 与细胞内结构域相连,例如整合素结合肽、抗血管内皮生长因子受体的多肽(抗 VEGFR2)、调蛋白(抗 Her3/4 受体)、或白细胞介素 (IL)-13 突变蛋白(抗 IL13 受体-a)。
使用源自鼠抗体的 scFv 的 CAR 策略的一个缺点是抗体和细胞介导的针对这些外来分子的反应的出现。为了避免这种不利影响,我们可以使用人源化 scFv 结构域或人类抗体来生产 CAR(Hombach 等人,2000 年,Lamers等人,1995 年)。
CAR T细胞信号转导
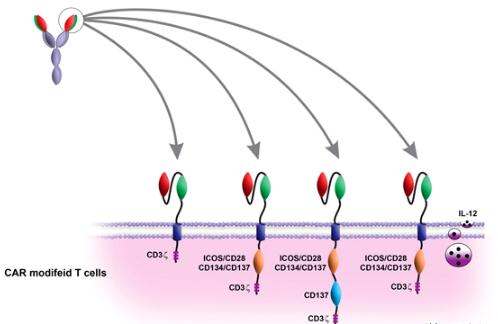
第一代 CAR 包含连接到 CD3ζ 细胞内信号结构域的 scFv(Eshhar 等,1993)。
第二代 CAR T 细胞由连接到 CD28 和CD3ζ 等共刺激域的 scFv 组成,这些域用于改善 CAR激活信号并增加增殖和细胞因子分泌(图 1)。CD28 和 B7 家族分子(例如位于靶细胞表面的 B7.1 和 B7.2)之间的相互作用提供了第二个激活信号,该信号增强了来自 TCR-CD3 复合物的“信号 1”。在第二代 CAR 中通过 CAR 分子传递信号 1 和信号 2 导致 T 细胞增殖、靶细胞裂解、IL-2 分泌和一些蛋白质的表达,例如抗凋亡蛋白 Bcl-xL。研究表明,针对 PSMA 的第二代 CAR T 细胞在 IL-2 产生和增殖方面比第一代有效得多。
为了改进 CAR 设计并增强第二代 CAR 的激活,开发了包含 3 个共刺激域的“第三代”CAR。第三代 CAR 提供信号 1、信号 2 和辅助共刺激信号以增强 T 细胞激活信号,包括CD28、4-1BB 和 CD3ζ。多项研究表明,表达第三代 CAR 的转基因 T 细胞可提高 T 细胞存活率、细胞因子产生和抗肿瘤潜力。
第四代 CAR 与其靶标之间的相互作用导致靶组织中的 CAR T 细胞激活 T 细胞并分泌 IL-12。IL-12 的积累是在局部肿瘤病变中吸引先天免疫细胞(主要是 NK 细胞和巨噬细胞)的重要策略。IL-12 是一种异源二聚体蛋白,由巨噬细胞和树突细胞响应细胞内病原体生理分泌(Trinchieri 等人,2003 年)。第四代 CAR 分泌 IL-12,导致 NK 细胞和巨噬细胞浸润到肿瘤部位,从而改善肿瘤根除。使用 CAR 的最佳肿瘤根除需要结合不同的信号结构域,这导致 T 细胞的完全激活以促进某些细胞因子的分泌。
CAR T细胞递送
为了实现有效的肿瘤根除,转基因 T 细胞应该转移到 CAR T 细胞能够靶向肿瘤细胞的肿瘤部位。事实上,基于 CAR 工程化 T 细胞的过继免疫疗法效率降低的主要原因是 T 细胞归巢到肿瘤部位的能力较差(Parente-Pereira 等人,2011 年)。已经通过在鼠肿瘤模型中对 CAR T 细胞进行双重生物发光成像证明了转基因 T 细胞向肿瘤部位的迁移。CAR T 细胞在大多数肿瘤部位的积累以及 CAR T 细胞的持续存在是有效根除肿瘤的主要原则。研究表明,表达第二代 CAR 的基因修饰 T 细胞将在疾病部位积聚。Brentjens 等人已经证明了将 CAR T 细胞贩运到多个部位,包括肝脏、淋巴结和骨髓。通过针对 CD19 的第二代 CAR。在另一项调查中,Savoldo 等人报道了非霍奇金淋巴瘤 (NHL) 患者在接受过继细胞治疗后转基因 T 细胞归巢到皮肤病变。
整合素和趋化因子等几种分子的过度产生与 T 细胞向肿瘤部位的运输有关。趋化因子及其受体在 CAR T 细胞归巢至肿瘤部位方面发挥着关键作用。克肖等人已经证明 CXCR2 和 CCR4 在 CAR 修饰的 T 细胞中的表达将增强 T 细胞向疾病部位的运输。
CAR T细胞的持久性
输注的 T 细胞存活率低限制了过继 T 细胞免疫疗法的效率。转基因 T 细胞需要存活足够长的时间才能完全成功地消除肿瘤。罗宾斯等人已经表明抗癌反应的功效与注入的 T 细胞的持久性相关。此外,淋巴细胞清除化疗还可以通过在注入 CAR T 细胞之前改变宿主环境来提高 CAR T 细胞的持久性。条件性化疗可以去除抑制性细胞,如调节性 T (Treg) 细胞和骨髓细胞,并增强 CAR T 细胞的持久性。
如临床前模型所示,调节性化疗和低剂量照射可以通过多种机制提高过继转移 T 细胞的存活率。布伦特詹斯等人报告了他们对 10 名慢性淋巴细胞白血病 (CLL) 或急性淋巴细胞白血病 (ALL) 患者的观察结果。在第一组中,患者接受了含有 CD28 抗 CD19 的第二代CAR 治疗,没有进行预处理化疗,并且表现出不可检测的持久性。有争议的是,对下一组接受先前淋巴细胞清除预处理化疗(环磷酰胺)的患者的观察表明,转基因 T 细胞在骨髓中过继转移后可以持续 6 周。
化疗方案可以减轻患者的疾病负担并增强注入的 T 细胞的持久性。Park 等人证明了患者肿瘤负荷与 CAR T 细胞持久性之间的相关性。转移性神经母细胞瘤患者。
另一种增强体内 T 细胞持久性的方法涉及应用经过基因修饰以表达 CAR 的病毒特异性 T 细胞。墨菲等人已经证明 CAR 特异性流感病毒 T 细胞在乳腺癌小鼠中的持久性增加。在另一项实验中,在神经母细胞瘤患者中观察到 CAR 特异性爱泼斯坦巴尔病毒 (EBV) T 细胞对 GD2 的持久性改善。在接受EBV 特异性 T 细胞治疗的患者中也观察到 CAR T 细胞在循环中的持续性增加长达 6 周,该 T 细胞经过 CAR 改造,该 T 细胞能够识别双唾液酸神经节苷脂 GD2,代表神经母细胞瘤细胞表达的抗原。
总之,调节化疗、细胞因子补充、患者的肿瘤负荷、T 细胞表型、共刺激信号传导以及可能使用病毒特异性 T 细胞是能够改善输注 T 细胞持久性的几个因素。
CAR T细胞和免疫抑制性肿瘤微环境
细胞溶解功能的维持是过继转移后 CAR 转基因 T 细胞成功根除肿瘤的重要因素。此外,几种机制可能会抑制过继转移的 CAR T 细胞的功能。这些机制包括抑制细胞,例如 Tregs 细胞、髓源性抑制细胞 (MDSC) 和免疫抑制分子/细胞因子(例如 TGF-β)。而且,上面提到的一些基因改造也可以帮助基因改造的T细胞抵抗肿瘤微环境中的免疫抑制因素。例如,将 CD28 等共刺激分子掺入 CAR 可以帮助 T 细胞对 Treg 细胞和 TGFβ更具抵抗力。AKT 的过度表达还可以增加 CAR 的抗性。抑制 TGFβ 作用的一种有前景的方法是表达诱饵形式的TGFβ 受体,这可以通过 CAR T 细胞设计中的遗传策略来实现。T 细胞的激活可以被 T 细胞表面表达的程序性细胞死亡蛋白 1 (PD1) 抑制。PD1与其在癌细胞表面表达的配体之间的相互作用可以抑制肿瘤微环境中CAR-T细胞的活化。通过小干扰 RNA (siRNA) 或 mAb 阻断 PD1 是减少这种免疫抑制形式的一种很有前景的方法。
基因修饰的 CAR T 细胞表达 IL-12 是另一种增强耐药性的策略,也可能改变肿瘤微环境。表达 IL12 的 T 细胞基因工程还可以增强抗肿瘤功能,并将提高抵抗 Treg 细胞施加的免疫抑制的能力。T 细胞分泌 IL-12 导致在肿瘤中形成免疫支持性骨髓细胞。发现表达嵌合 NKG2D 的转基因 T 细胞可改善细胞因子分泌,导致骨髓细胞从免疫抑制表型转变为免疫刺激表型。李等人已经证明预处理化疗还可以减少Treg 的数量并改善 T 细胞的抗肿瘤功能。其他免疫抑制因子如半乳糖凝集素和氨基酸代谢物也可能抑制 CAR T 细胞的功能,未来旨在阻断这些因子的方法可能会产生更有效的肿瘤特异性 T 细胞。
CAR T细胞的毒性
不需要的毒性是一个主要问题,可以限制基于 CAR T 细胞的免疫疗法。转基因 T 细胞必须识别仅在肿瘤表面表达的抗原。摩根等人用针对 ERBB2 的第三代 CAR 治疗结肠癌患者。接受淋巴细胞清除化疗的患者在输注 CAR T 细胞后 5 天死亡。转基因 CAR T 细胞和ERBB2 之间的相互作用导致促炎细胞因子的释放。因此,在输注 T 细胞后观察到患者的肺毒性、多器官衰竭和死亡。在另一项临床研究中,11 名肾细胞癌患者接受了识别 CAIX 的第一代 CAR 工程 T 细胞治疗,CAIX 代表肾细胞表达的抗原。在输注 CAR T 细胞后,靶向胆管上皮细胞中的 CAIX 导致 5 名患者出现严重的肝毒性。
在另一项临床试验中,8 名接受转基因 T 细胞治疗以表达 MAGE-A3 特异性 CAR 的患者中,有 2 名报告了神经毒性。得出的结论是,神经毒性是在某些神经元上表达的 MAGE-12 与仅在肿瘤上表达的 MAGE-A3 之间交叉反应的结果。这些研究表明需要仅在癌细胞上表达的肿瘤靶向抗原。
不同代 CAR T 细胞的临床试验
多项研究评估了第一代 CAR 修饰的 T 细胞的抗肿瘤效果。在使用第一代 CAR T 细胞的早期临床试验中没有发现显着结果。此外,这些临床试验在靶向抗原选择、基因转移方法、体外扩增技术、外源性IL-2注射、细胞剂量、调理疗法的使用等方面也存在一定差异。CD4+和CD8+T淋巴细胞在癌症治疗中起重要作用。CD8+ CTLs 能够有效地根除肿瘤细胞,而 CD4+ T 淋巴细胞可以通过增强某些细胞因子的分泌来提高抗原呈递细胞 (APC) 的能力和 CTLs 的抗肿瘤功能。基于 CAR 的免疫疗法被开发用于免疫系统的细胞和体液武器,以有效根除肿瘤。
表达 CAR 的转基因 T 细胞能够在体外根除恶性细胞,并且在各种动物模型中注入工程化 T 细胞可以缓解肿瘤。最近基于将 CAR 工程 T 细胞注入肿瘤患者的临床试验表明,这种方法是可行且安全的。
尽管从临床研究中得出了一些有希望的结果,但也报告了一些可能限制 CAR T 细胞功效的副作用。此外,有害的毒性是几个临床研究中观察到的主要问题。基于CAR 修饰的 T 细胞的免疫治疗方法的另一个问题是它们对适当的表面肿瘤相关抗原 (TAA) 的可用性有限。最后,注入的 CAR 转基因 T 细胞的持久性较差,导致抗肿瘤反应受限。
其次,还开发了第三代和第四代 CAR 移植 T 细胞以克服这一障碍。这几代CARs表现出增加的增殖率和增加的细胞因子分泌,并且在肿瘤微环境的免疫抑制机制中更加持久。
预计在不久的将来,许多努力将特别集中在第三代和第四代CARs的开发上,以在癌症治疗方面取得更成功的结果。
上一篇: 细胞移植免疫治疗恶性肿瘤有哪些
